MINI RECENZE
Základna proti rakovině: univerzální markery pouze pro rakovinu
Chengchen Qian1, Xiaolong Zou2, Wei Li1,3, Yinshan Li4, Wenqiang Yu5
1Shanghai Epiprobe Biotechnology Co., Ltd, Shanghai 200233, Čína;2 Oddělení všeobecné chirurgie, První přidružená nemocnice Harbinské lékařské univerzity, Harbin 150001, Čína;3Shandong Epiprobe Medical Laboratory Co., Ltd, Heze 274108, Čína;4 Lidová nemocnice autonomní oblasti Ningxia Hui, lékařská univerzita Ningxia, Yinchuan 750002, Čína;5Shanghai Public Health Clinical Center & Department of General Surgery, Huashan Hospital & Cancer Metastasis Institute & Laboratory of RNA Epigenetics, Institutes of Biomedical Sciences, Shanghai Medical College, Fudan University, Shanghai 200032, China
ABSTRAKTNÍ
Rakovina je celosvětově hlavní příčinou úmrtí.Včasné odhalení rakoviny může snížit úmrtnost všech typů rakoviny;u většiny typů rakoviny však chybí účinné biomarkery časné detekce.Metylace DNA byla vždy hlavním cílem zájmu, protože k methylaci DNA obvykle dochází před jinými detekovatelnými genetickými změnami.Při zkoumání společných rysů rakoviny pomocí nového vodícího polohovacího sekvenování pro methylaci DNA se řada univerzálních markerů pouze pro rakovinu (UCOM) ukázala jako silní kandidáti pro účinnou a přesnou včasnou detekci rakoviny.Zatímco klinická hodnota současných nádorových biomarkerů je snížena nízkou senzitivitou a/nebo nízkou specificitou, jedinečné vlastnosti UCOM zajišťují klinicky významné výsledky.Validace klinického potenciálu UCOM u rakoviny plic, děložního čípku, endometria a urotelu dále podporuje aplikaci UCOM u různých typů rakoviny a různých klinických scénářů.Ve skutečnosti jsou aplikace UCOM v současné době aktivně zkoumány s dalším hodnocením v časné detekci rakoviny, pomocné diagnóze, účinnosti léčby a sledování recidivy.Molekulární mechanismy, kterými UCOM detekují rakovinu, jsou další důležitá témata, která je třeba zkoumat.Aplikace UCOM ve scénářích reálného světa také vyžaduje implementaci a zdokonalení.
KLÍČOVÁ SLOVA
Detekce rakoviny;screening rakoviny;methylace DNA;epigenetika rakoviny;biomarkery rakoviny
Proč nutně potřebujeme nové biomarkery?
Po boji s rakovinou po více než století je rakovina stále nejsmrtelnější biologickou hrozbou pro lidstvo.Rakovina zůstává celosvětovým zdravotním problémem s 19,3 miliony nových případů a téměř 10 miliony úmrtí odhadovaných v roce 20201. V roce 2020 bylo v Číně diagnostikováno odhadem 4,6 milionu nových případů rakoviny, což představuje 23,7 % nových případů rakoviny na celém světě podle GLOBOCAN1.Kromě toho byly v roce 2020 v Číně připsány přibližně 3 miliony úmrtí na rakovinu, což bylo 30 % celosvětových úmrtí souvisejících s rakovinou1.Tyto statistiky ukázaly, že Čína je na prvním místě ve výskytu a úmrtnosti na rakovinu.Kromě toho je 5letá míra přežití rakoviny 40,5 %, což je 1,5krát méně než 5letá míra přežití ve Spojených státech2,3.Poměrně nižší míra přežití a vyšší úmrtnost v Číně než v zemích s vyššími indexy lidského rozvoje naznačují, že je naléhavě zapotřebí účinný a nákladově efektivní systém prevence a sledování rakoviny.Včasné odhalení rakoviny je jedním z nejdůležitějších prvků v systému zdravotní péče.Včasná detekce rakoviny může zlepšit prognózu a přežití v rané fázi téměř u všech typů rakoviny4.Úspěšné screeningové strategie vedly k významnému poklesu incidence a mortality rakoviny děložního čípku, prsu, kolorektálního karcinomu a rakoviny prostaty.
Dosáhnout včasného odhalení rakoviny však není snadný úkol.Zkoumání biologie a prognózy časné rakoviny, identifikace a ověřování spolehlivých biomarkerů včasné detekce a vývoj dostupných a přesných technologií časné detekce byly vždy největší překážkou v tomto procesu4.Přesná detekce rakoviny dokáže odlišit benigní léze od maligních, což pomáhá vyhnout se zbytečným procedurám a usnadňuje další léčbu onemocnění.Současné strategie časné detekce zahrnují biopsie založené na endoskopu, lékařské zobrazování, cytologii, imunotesty a testy biomarkerů5-7.Vzhledem k tomu, že biopsie založené na endoskopu jsou rušivé a nákladné, nesou ze své podstaty velkou zátěž jako hlavní lékařský postup, který závisí na profesionálním personálu.Stejně jako cytologie závisí obě screeningové metody na lékařských profesionálech a jsou založeny na osobním úsudku s výkonem, který není zdaleka ideální8.Naproti tomu imunotesty jsou vysoce nepřesné, vzhledem k vysoké míře falešně pozitivních výsledků.Lékařské zobrazování jako screeningová taktika vyžaduje drahé vybavení a specializované techniky.Lékařské zobrazování je proto extrémně omezené kvůli nízké dostupnosti.Ze všech těchto důvodů se biomarkery jeví jako lepší možnost pro včasnou detekci rakoviny.
Korespondence s: Yinshan Li a Wenqiang Yu
Email: liyinshan@nxrmyy.com and wenqiangyu@fudan.edu.cn
ID ORCID: https://orcid.org/0009-0005-3340-6802 a
https://orcid.org/0000-0001-9920-1133
Přijato 22. srpna 2023;přijato 12. října 2023;
zveřejněno online 28. listopadu 2023.
Dostupné na www.cancerbiomed.org
©2023 Biologie a medicína rakoviny.Creative Commons
Mezinárodní licence Attribution-NonCommercial 4.0
Biomarkery jsou v současnosti kategorizovány jako proteiny, DNA mutační markery, epigenetické markery, chromozomální abnormality, RNA markery odvozené přímo z nádorů nebo nádorové fragmenty získané nepřímo z tělních tekutin.Proteinové markery jsou nejrozšířenějšími biomarkery ve screeningu a diagnostice rakoviny.Proteinové biomarkery jako screeningové biomarkery jsou omezeny tendencí být ovlivněny benigními lézemi, což vede k nadměrné diagnóze a nadměrné léčbě, jak bylo popsáno u α-fetoproteinu a prostatického specifického antigenu (PSA)9,10.RNA markery zahrnují genetické expresní vzory a další nekódující RNA markery. Kombinaci genetických expresních RNA markerů lze detekovat pomocí vzorků moči, jejichž citlivost zdaleka nebyla uspokojivá (60 %) pro primární nádory a jejichž detekce může být být ovlivněn snadnou degradací RNA v normálním prostředí11.Genetické i epigenetické markery čelí problému prevalence v nádorech a omezení na typy rakoviny.
Metylace DNA je silným kandidátem na biomarker časné detekce od té doby, co ji Feinberg v roce 1983 poprvé spojil s rakovinou12. Aberace metylace DNA jsou pozorovány ve všech stadiích rakoviny, již v prekancerózním stadiu.Aberantní hypermetylace DNA obvykle probíhá na CpG ostrovech v genových promotorech, aby působila proti supresorům nádorů13,14.Studie také naznačují, že abnormální hypermethylace DNA se podílí na upregulaci vývojových regulátorů15.Údolí metylace DNA, které je běžně spojováno s vývojovými regulátory a hypermetylovanými rakovinami, by mohlo přepnout režim genové exprese na stabilnější režim závislý na metylaci DNA a snížit spojení s metylovaným histonem H3K27me3 a souvisejícími polycomb proteiny16,17.
Mezi velkým počtem publikovaných markerů methylace DNA jich několik úspěšně debutovalo na trhu;Současné komercializované markery methylace DNA a diagnostické panely však z mnoha důvodů ještě plně neuvolnily potenciál včasné detekce rakoviny18.I když většinou vykazují přijatelný výkon pomocí databázových informací, tyto biomarkery obvykle fungují méně ideálně v reálném světě kvůli skutečnosti, že vzorky z reálného světa jsou často složitější a nejsou tak reprezentativní jako ty vybrané v databázích.Ukázalo se, že časná detekce metylace multirakovinné metylace na bázi sekvenování nové generace má u karcinomů stadia I a II citlivost pouhých 16,8 % a 40,4 %19.Testy včasné detekce vyžadují větší stabilitu a přesnější biomarkery.
Objev univerzálního markeru rakoviny (UCOM) pomocí sekvenování určování polohy (GPS)
Navzdory desetiletím výzkumu rakoviny nebyla realizována uspokojivá prevence a léčba.Jsou zapotřebí nové metodiky, které výzkumníkům umožní důkladně vyhodnotit rakovinu.Za posledních 23 let bylo 6 charakteristických znaků rakoviny, jako je vyhýbání se apoptóze, tkáňové invaze a metastázy atd., rozšířeno na 14 zahrnutím funkcí, jako je nemutační epigenetické přeprogramování a polymorfní mikrobiomy20,21.S odhalováním dalších podrobností týkajících se rakoviny se do výzkumu rakoviny zavádí více perspektiv.Výzkum rakoviny se postupně proměnil ve dvou směrech (společnost a individualita).S rozvojem precizní onkologie v posledních letech se těžiště výzkumu rakoviny přiklání k individualizované cílené terapii a heterogenitě rakoviny22.Nedávno identifikované nádorové biomarkery se tedy zaměřily hlavně na specifické typy rakoviny, jako je PAX6 forcervikální karcinom23 a BMP3 pro kolorektální karcinom24.Výkon těchto biomarkerů specifických pro typy rakoviny se liší, ale stále není možné, aby vnímaví jedinci podstoupili screening na všechny druhy rakoviny současně, a to z důvodu omezení odběru biologických vzorků a vysokých nákladů.Ideální by bylo, kdybychom dokázali identifikovat jediný robustní biomarker, který by byl účinný u všech typů rakoviny v raném stádiu.
K dosažení takového ideálního cíle musí být ze seznamu potenciálních typů biomarkerů vybrán lepší kandidát na biomarker.Je známo, že aberace metylace DNA mezi všemi genetickými a epigenetickými profily souvisejí s rakovinou a jsou jedny z prvních, ne-li první, abnormalit souvisejících s rakovinou, které se vyskytují chronologicky.Vyšetřování metylace DNA začalo brzy, ale bylo brzděno nedostatkem výzkumných metod.Mezi 28 miliony potenciálních methylovaných CpG míst v genomu musí být detekován zvládnutelný počet a zarovnán s genomem, aby bylo možné lépe porozumět tumorigenezi.Bisulfitové sekvenování celého genomu (WGBS), které je považováno za zlatý standard methylačního sekvenování DNA, může pokrýt pouze 50 % Cs v rakovinných buňkách kvůli povaze bisulfitového ošetření, které rozbíjí fragmenty DNA a snižuje složitost genomu během transformace Cs-na-Ts25.Jiné metody, jako například 450k čipy, pokrývají pouze 1,6 % metylace genomu.Na základě 450 000 dat má panel detekce metylace DNA 35,4% senzitivitu pro 6 typů rakoviny stadia I26.Omezení typů rakoviny, špatný výkon a šum generovaný detekčními metodami v analytickém procesu se staly největší překážkou pro panely pro detekci rakoviny.
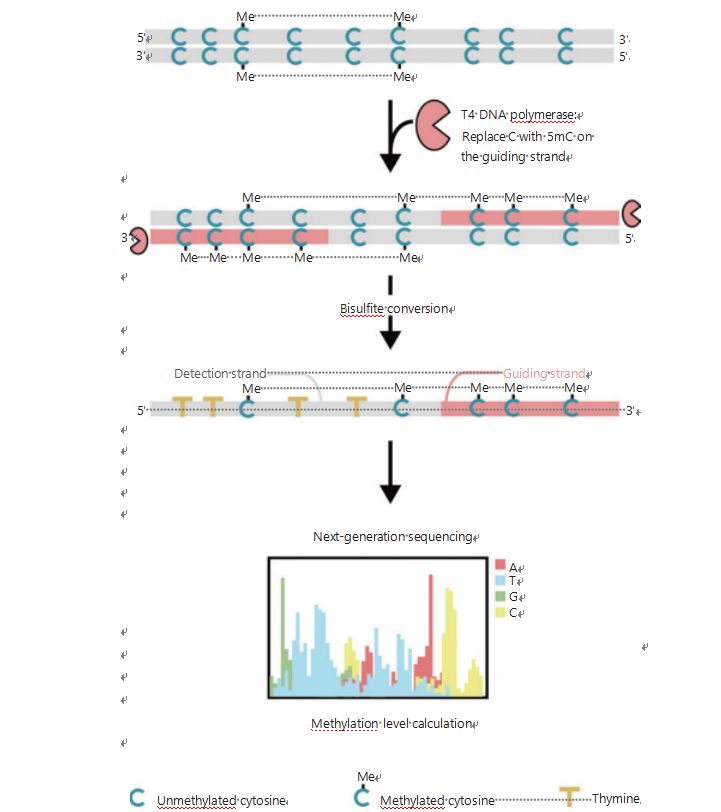
Abychom lépe prozkoumali epigenetické vzorce buněk během tumorigeneze a metastáz, vyvinuli jsme unikátní GPS pro detekci metylace DNA v celém genomu, která pokrývá až 96 % míst CpG při 0,4 miliardách čtení25.GPS je bilaterální sekvenační metoda využívající 3′ konec fragmentu DNA nekonvertibilních methylcytosinů po bisulfitové úpravě, která řídí seřazení výpočtu metylace DNA na 5′ konci pomocí párového sekvenování (obrázek 1)25.Řídicí řetězec methyl-cytosinu, který působí jako templátový řetězec, pomáhá při zarovnání oblastí s vysokým GC, které obnovuje nejvíce opuštěná sekvenační data v tradičním WGBS.Funkce vysokého pokrytí GPS poskytuje obrovské množství informací o metylaci DNA, což nám umožňuje zkoumat profily metylace rakoviny s výrazně vyšším rozlišením v dříve nedostatečně prozkoumaných oblastech.
GPS nám poskytuje mocný nástroj pro zkoumání homogenity rakoviny, který může výrazně zjednodušit výzkum rakoviny a potenciálně najít univerzální vysvětlení pro tumorigenezi a metastázy.Při analýze GPS dat rakovinných buněčných linií jsme často narazili na unikátní jev.Existovala řada oblastí, které se zdály být abnormálně hypermetylované v různých typech vzorků rakoviny.Toto neočekávané zjištění bylo následně ověřeno, aby sloužilo jako UCOM.Bylo analyzováno více než 7 000 vzorků ze 17 typů rakoviny v databázi The Cancer Genome Atlas (TCGA), mezi nimiž jsme identifikovali první UCOM, HIST1H4F, gen související s histony, který je hypermetylovaný u všech typů rakoviny27.Poté byla nalezena řada UCOM a ověřena v databázi TCGA, databázi Gene Expression Omnibus (GEO) a skutečných klinických vzorcích.V současné době byly nalezeny a ověřeny HIST1H4F, PCDHGB7 a SIX6 jako UCOM.Nečekaný objev UCOM nabízí silnou odpověď na potřebu včasné detekce rakoviny.UCOM poskytují řešení pro detekci více druhů rakoviny s jedním markerem.
Charakteristika UCOM
Po validaci se ukázalo, že UCOM vykazují čtyři hlavní charakteristiky, které umožňují UCOM překonat účinnost současných biomarkerů (obrázek 2).
Jedinečné pro malignitu
UCOM jsou jedinečné pro rakovinné nebo prekancerózní léze a nejsou ovlivněny normálními fyziologickými změnami.Některé ze současných markerů souvisejících s rakovinou, které byly široce používány při časné detekci a/nebo screeningu, vedly k nadměrné diagnóze.Zvýšené hladiny PSA, klinicky akreditovaný screeningový nástroj, jsou také detekovány u benigních stavů, jako je hyperplazie prostaty a prostatitida10.Nadměrná diagnóza a následná nadměrná léčba vede ke snížení kvality života v důsledku střevních, močových a sexuálních komplikací28.Jiné biomarkery založené na proteinech a široce používané v klinickém prostředí, jako je CA-125, nepřinesly žádné významné přínosy, zatímco u nich došlo k nadměrné diagnóze a nadměrné léčbě29.Vysoká specificita UCOM pro malignity těmto nedostatkům předchází.UCOM, PCDHGB7, účinně rozlišuje skvamózní intraepiteliální léze vysokého stupně (HSIL) a karcinom děložního čípku od normálních vzorků a dlaždicové intraepiteliální léze nízkého stupně (LSIL), zatímco většina ostatních biomarkerů dokáže odlišit karcinom děložního hrdla od normálních vzorků pouze30.Ačkoli PCDHGB7 nedetekuje významné rozdíly mezi normálním endometriem a hyperplazií endometria, významné rozdíly jsou detekovány mezi normálním endometriem a atypickou hyperplazií a ještě větší rozdíly jsou detekovány mezi normálním endometriem a karcinomem endometria (EC) na základě PCDHGB731.UCOM jsou jedinečné pro maligní léze v databázích a klinických vzorcích.Z pohledu pacienta jedinečné UCOM snižují práh pro pochopení komplexních indikací různých nestabilních biomarkerů s nízkou výkonností a odpovídající úzkosti během procesu hodnocení.Z pohledu lékaře unikátní UCOM odlišují malignity od benigních lézí, což pomáhá při třídění pacientů a snižuje zbytečné lékařské postupy a přeléčení.Jedinečné UCOM proto snižují redundanci lékařského systému, zmírňují tíseň systému a zpřístupňují více lékařských zdrojů těm, kteří to potřebují.
Obrázek 1 Schéma pracovního postupu GPS pro detekci metylace DNA25.Šedá čára: vstupní sekvence DNA;červená čára: DNA ošetřená T4 DNA polymerázou, nahrazující cytosin 5'-methylcytosinem na 3' konci vstupu;modrá C s Me: methylovaný cytosin;modrá C: nemethylovaný cytosin;žlutá T: thymin25.
Všechno nebo nic
UCOM jsou přítomny pouze v rakovinných buňkách a jsou stabilně detekovány téměř ve všech rakovinných buňkách.Bylo ověřeno, že HIST1H4F je hypermetylovaný u téměř všech typů nádorů, ale ne u normálních vzorků27.Podobně se také ukázalo, že PCDHGB7 a SIX6 jsou hypermethylované ve všech vzorcích nádorů, ale ne v normálních vzorcích30-32.Tato jedinečná vlastnost výrazně zlepšuje výkon UCOM s ohledem na limit detekce a citlivosti.Ve vzorcích lze diferencovat pouze 2 % rakovinných buněk, což z UCOM dělá mnohem citlivější biomarker než většina existujících biomarkerů30. Jako biomarker používaný pro detekci kolorektálního karcinomu existují mutace KRAS pouze u přibližně 36 % případů kolorektálního karcinomu, naznačuje slabý diagnostický potenciál33.Nízká prevalence mutací KRAS u kolorektálního karcinomu limituje KRAS v kombinaci s dalšími biomarkery.Ve skutečnosti se kombinace biomarkerů může zpočátku zdát slibná, ale ne vždy generuje uspokojivý výsledek a zároveň vykazuje mnohem větší šum v detekční analýze a obvykle zahrnuje komplikovanější experimentální postupy.Naproti tomu PCDHGB7 a další UCOM existují u všech rakovin.UCOM detekují rakovinné složky v různých typech vzorků rakoviny s nejvyšší přesností a zároveň eliminují složité procesy analýzy potlačení šumu.Není těžké detekovat rakovinu v hojném vzorku, ale je extrémně náročné detekovat rakovinu v malém vzorku.UCOM jsou schopny detekovat malá množství rakoviny.
Obrázek 2 Charakteristika UCOM.
Detekce rakoviny předcházející patologickým změnám
UCOM lze detekovat v prekancerózním stádiu před patologickými změnami.Jako epigenetické biomarkery se abnormality UCOM vyskytují v časnějším stadiu než fenotypové abnormality a jsou detekovatelné během tumorigeneze, progrese a metastáz34,35.Citlivost UCOM v průběhu času zvyšuje výkon UCOM při detekci raného stadia rakoviny a prekancerózních lézí.Odhalení časné rakoviny na základě biopsií a cytologie může být obtížné i pro ty nejzkušenější patology.Jediná biopsie získaná kolposkopií byla hlášena jako pozitivní u 60,6 % vzorků HSIL+.U vícečetných lézí jsou ke zvýšení citlivosti nutné další biopsie36.Naproti tomu UCOM, PCDHGB7, má citlivost 82 % pro vzorky HSIL+, čímž převyšuje citlivost biopsií a většiny biomarkerů30.Methylační marker, FAM19A4, má citlivost 69 % pro CIN2+, což je podobné cytologii, ale nedokáže odlišit CIN1 od normálních vzorků37.Ukázalo se, že UCOM jsou mnohem citlivějším biomarkerem časné detekce.Ve srovnání s patology založenými na zkušenostech mají UCOM lepší detekční senzitivitu pro rané stadium rakoviny, což zase přispívá ke zlepšení prognózy a přežití rakoviny30.Navíc UCOM nabízejí detekční platformu, která je přístupná oblastem bez zkušených patologů a výrazně zlepšuje efektivitu detekce.Díky jednotným postupům odběru vzorků a detekce poskytuje detekce UCOM stabilní a snadno interpretovatelné výsledky, které lépe vyhovují screeningovému protokolu vyžadujícímu méně odborného personálu a lékařských zdrojů.
Snadno zjistitelné
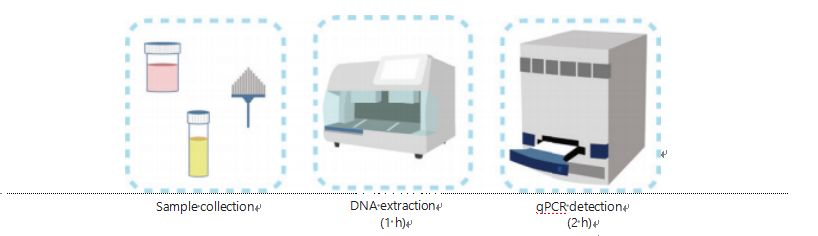
Současné metody detekce metylace DNA jsou složité a časově náročné.Většina metod vyžaduje bisulfitovou transformaci, která způsobuje ztrátu kvality vzorku a může vést k nestabilním a nepřesným výsledkům.Špatná reprodukovatelnost způsobená bisulfitovou léčbou potenciálně vede ke zmatení lékařů a pacientů a dále interferuje s následnými a/nebo léčebnými strategiemi.Proto jsme dále upravili metodu detekce UCOM, abychom se vyhnuli problematické bisulfitové úpravě vzorků, vyhověli požadavkům klinické aplikace a zlepšili dostupnost.Vyvinuli jsme novou metodu využívající restrikční enzymy citlivé na methylaci v kombinaci s fluorescenční kvantitativní PCR v reálném čase (Me-qPCR) ke kvantifikaci stavu metylace UCOM do 3 hodin pomocí postupů snadné manipulace (obrázek 3).Me-qPCR může pojmout více typů vzorků, jako je klinický odběr tělních tekutin a samosběrné vzorky moči.Odebrané klinické vzorky lze zpracovat, uložit a snadno přejít k detekci pomocí standardizované a automatizované extrakce DNA.Extrahovaná DNA pak může být přímo aplikována na platformu Me-qPCR pro reakci v jedné nádobě a výstupní výsledky kvantifikace.Po jednoduché analýze výsledků pomocí diagnostických modelů přizpůsobených a validovaných pro konkrétní typy rakoviny je konečné stanovení výsledků detekce UCOM interpretováno a prezentováno jako semikvantitativní hodnota.Platforma Me-qPCR překonává tradiční bisulfitové pyrosekvenování v detekci UCOM a zároveň šetří 3 hodiny hydrogensiřičitanové konverze, podle protokolu kitu EZ DNA Methylation-Gold.Inovativní platforma detekce metylace činí detekci UCOM stabilnější, přesnější a dostupnější30.
Obrázek 3 Proces detekce UCOM.Typy vzorků zahrnují profesionálně odebraný BALF, Pap kartáč a/nebo moč odebraná z vlastního odběru.Proces extrakce DNA lze přizpůsobit automatickému extraktoru, jehož produkt lze přímo detekovat pomocí qPCR.
Aplikace UCOM
Rakovina plic
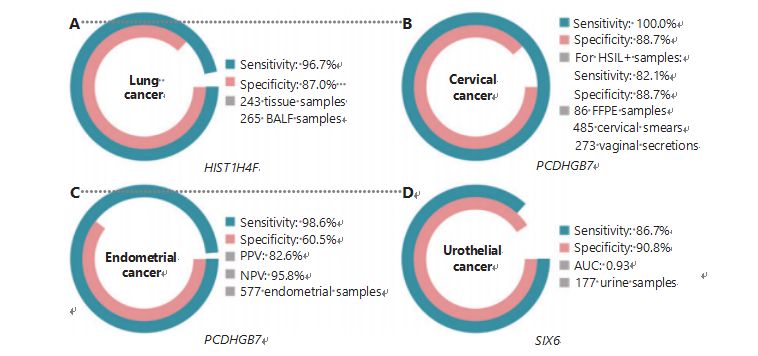
Rakovina plic je celosvětově druhou nejčastěji diagnostikovanou a nejsmrtelnější rakovinou, která představuje 11,4 % nových případů a 18,0 % nových úmrtí1.Mezi všemi diagnózami je 85 % nemalobuněčný karcinom plic (NSCLC) a 15 % malobuněčný karcinom plic (SCLC), který má vyšší úroveň malignity38.Nízkodávkovaná počítačová tomografie (LDCT) je v současnosti doporučovanou metodou screeningu rakoviny plic a bylo prokázáno, že zlepšuje včasnou detekci a snižuje úmrtnost6;vzhledem k nízké specifitě a špatné dostupnosti však LDCT dosud nesloužila jako uspokojivá screeningová metoda, stejně jako jiné běžné markery rakoviny, jako je CEA39.Náklady a potenciál zmeškaných diagnóz a chybných diagnóz strategie screeningu LDCT brání pokroku v propagaci screeningu rakoviny plic40.HIST1H4F, UCOM, má obrovský potenciál jako biomarker časné detekce ve vzorcích bronchoalveolární tekutiny (BALF)27.HIST1H4F je hypermetylovaný u adenokarcinomu plic a spinocelulárního karcinomu plic se specificitou detekce 96,7 % a senzitivitou 87,0 % (obrázek 4A) a výjimečným výkonem u rakoviny I. stadia27.HIST1H4F má specificitu 96,5 % a senzitivitu 85,4 % pro NSCLC a 96,5 % a 95,7 % pro SCLC27.Kromě toho vzorky osmi dalších typů rakoviny, včetně rakoviny slinivky břišní a kolorektálního karcinomu, potvrdily, že HIST1H4F je hypermetylovaný u všech osmi typů27.
Rakovina děložního hrdla
Rakovina děložního čípku byla čtvrtou nejčastěji diagnostikovanou rakovinou a čtvrtou nejčastější příčinou úmrtí na rakovinu u žen v roce 2020, což představuje 3,1 % nových případů a 3,4 % úmrtí souvisejících s rakovinou na celém světě1.K odstranění rakoviny děložního čípku do roku 2030, jak navrhuje WHO, je včasné odhalení rakoviny děložního čípku nutností.Je-li zjištěna v časné fázi, dosahuje pětileté přežití u invazivního karcinomu děložního hrdla 92 %41.Pokyny American Cancer Society (ACS) navrhují cervikální cytologické testy, primární HPV testy nebo cotesty pro screening42.Cervikální cytologie je invazivní a dokáže detekovat pouze 63,5 % případů CIN2+37.
Naproti tomu PCDHGB7 fungoval mnohem lépe při použití Pap stěrů a vaginálních sekretů a může účinně odlišit HSIL od LSIL v ultra časném stádiu.Samotný PCDHGB7 má senzitivitu 100,0 % a specificitu 88,7 % pro rakovinu děložního čípku (obrázek 4B) a 82,1 % senzitivitu a 88,7 % specificitu pro vzorky HSIL+30.PCDHGB7 má také 90,9% senzitivitu a 90,4% specificitu ve vzorcích vaginálního sekretu pro rakovinu děložního čípku, které se sbírají mnohem snadněji30.V kombinaci s vysoce rizikovým (hr)HPV testem nebo Thinprep Cytologickým testem (TCT) má PCDHGB7 zvýšenou senzitivitu 95,7 % a specificitu 96,2 %, což výrazně předčí test hrHPV (20,3 %), TCT (51,2 %) ) a oba dohromady (57,8 %) pro rakovinu děložního čípku30.Bylo také prokázáno, že PCDHGB7 je hypermetylovaný u 17 typů rakoviny z databáze TCGA, což naznačuje jeho vhodnost v rodině UCOM30.
Obrázek 4 UCOM byly validovány u čtyř typů rakoviny v rozsáhlých klinických studiích.A. Výkon HIST1H4F, UCOM, při detekci rakoviny plic u 508 vzorků.B. Výkon PCDHGB7, UCOM, při detekci rakoviny děložního čípku u 844 vzorků.C. Výkon PCDHGB7, UCOM, při detekci karcinomu endometria u 577 vzorků endometriálního Pap a Tao kartáčku.D. Výkon SIX6, UCOM, při detekci uroteliálního karcinomu u 177 vzorků.
EC
EC je celosvětově jednou z nejčastějších rakovin ženského reprodukčního systému, s odhadem 4,2 milionu nových případů a 1 % úmrtí souvisejících s rakovinou ročně1.S úspěšnou diagnózou v raném stadiu je EC vyléčitelná a má 5letou míru přežití 95 % pro rakovinu stadia I.Pacientky, které jsou symptomatické, jako je abnormální děložní krvácení, jsou pravidelně klinicky hodnoceny a podstupují invazivní a bolestivé biopsie, přestože se EC43 nakonec rozvine pouze u 5–10 %.Transvaginální ultrazvuk, jako běžná detekční metoda, je vysoce nespolehlivý kvůli své neschopnosti odlišit benigní a maligní endometriální změny a vysoké četnosti falešně pozitivních nálezů44.
Bylo provedeno paralelní srovnání sérového CA-125, široce implementovaného EC biomarkeru, a PCDHGB7.Sérum CA-125 mělo senzitivitu 24,8 %, což naznačuje, že CA-125 je neadekvátní marker pro EC navzdory specificitě 92,3 %31.Detekce PCDHGB7 pomocí vzorků Pap kartáčku poskytla senzitivitu 80,65 % a specificitu 82,81 % pro stadia ECatall, zatímco kartáč Tao měl citlivost 61,29 % a specificitu 95,31 %31.Diagnostický model PCDHGB7 založený na Me-qPCR poskytl senzitivitu 98,61 %, specificitu 60,5 % a celkovou přesnost 85,5 % při použití vzorků kartáčku Pap a Tao (obrázek 4C)31.
Uroteliální rakovina
Uroteliální karcinom, skládající se z karcinomu močového měchýře, ledvinové pánvičky a močovodu, byl v roce 2020 celosvětově sedmým nejčastěji diagnostikovaným karcinomem a způsobil 5,2 % nových případů a 3,9 % úmrtí1.Uroteliální karcinomy, z nichž více než 50 % tvoří karcinom močového měchýře, byly v roce 2022 čtvrtou nejčastěji diagnostikovanou rakovinou ve Spojených státech, což představuje 11,6 % nově diagnostikovaných případů3.Přibližně 75 % karcinomů močového měchýře je klasifikováno jako neinvazivní karcinom močového měchýře omezený na sliznici nebo submukózu45.Cystoskopická biopsie je zlatým standardem pro diagnostiku uroteliálního karcinomu realizovaná fluorescenční in situ hybridizací (FISH) a cytologickými testy.FISH a cytologie mají špatnou diagnostickou výkonnost a cystoskopie je rušivá a má základní riziko chybějících mikrolézí, nesprávné interpretace lézí a potenciálního rozšíření nebo relapsu rakoviny46.Bylo také prokázáno, že dříve ověřený UCOM, PCDHGB7, je hypermetylovaný u uroteliálního karcinomu, s plochou pod křivkou 0,86, což naznačuje potenciální diagnostickou schopnost30.Pro další ověření většího počtu UCOM a lepší přizpůsobení většímu počtu typů vzorků byl zkoumán SIX6, nový UCOM, který prokázal vynikající diagnostický potenciál v časné detekci uroteliálního karcinomu pomocí vzorků moči na platformě Me-qPCR.Detekce SIX6 pomocí vzorků moči prokázala kompetitivní senzitivitu 86,7 % a specificitu 90,8 % (obrázek 4D), přičemž byla neinvazivní a byla snadno získatelná32.V současné době se zkoumá potenciál SIX6 při monitorování metastáz a hodnocení účinnosti léčby.
Budoucnost a výzvy
UCOM mají silný výkon v diagnostickém potenciálu mnohočetných rakovin, ale zbývá ještě mnoho práce.Rozšiřujeme seznam UCOM a aktivně ověřujeme UCOM u více typů rakoviny, včetně těch, které jsou tradičně obtížně detekovatelné.Výsledky validace z databází TCGA dále potvrdily použití UCOM u více typů rakoviny a více situací.V předběžném výzkumu se ukázalo, že UCOM mají silný diagnostický potenciál pro cholangiokarcinomy a adenokarcinomy pankreatu, které je téměř nemožné diagnostikovat v raném stádiu současnými screeningovými metodami32,47.Schopnost detekovat vzácné rakoviny pomocí UCOM lze využít s cirkulující nádorovou DNA (ctDNA) pomocí vylepšené platformy pro tekutou biopsii48.Studie zahrnující panel detekce rakoviny plazmy na bázi DNA poskytla citlivost 57,9 %49.Navzdory vysoké specifičnosti celkový výkon prozrazuje, že je stále co zlepšovat.
Jedinečné vlastnosti UCOM také podpořily zkoumání potenciálu UCOM při hodnocení účinnosti léčby a monitorování recidivy.Podle Response Evaluation Criteria in Solid Tumors (RECIST) je lékařské zobrazování doporučenou metodikou pro monitorování recidivy a hodnocení účinnosti léčby, zatímco nádorové markery se k hodnocení používají samostatně50.Ve skutečnosti jsou však zobrazovací přístupy značně ovlivněny frekvencí a načasováním, a proto vystavují pacienty vyššímu riziku a nákladům51,52.Bylo ověřeno, že SIX6 slouží jako prediktor pro metastázy rakoviny prsu32.Monitorování ctDNA založené na tekuté biopsii umožňuje sledování minimálního reziduálního onemocnění měsíce před radiologickou detekcí v reálném čase, což v ideálním případě zpomaluje a předchází progresi rakoviny související s relapsem53.Předběžné výsledky naznačují, že UCOM odrážejí úroveň rakovinné hypermetylace v reálném čase bezprostředně po operaci a léčbě32.Vysoká citlivost vykazovaná UCOM a použitelnost v několika neintruzivních typech vzorků umožňuje UCOM sloužit jako přesný biomarker pro monitorování recidivy při zachování vysoké compliance pacienta.
Veřejná dostupnost testu je zároveň dalším velkým problémem, který vyžaduje další úsilí.Zatímco spolupráce v oblasti detekce UCOM byla přijata ve více nemocnicích v naději, že bude přínosem pro více pacientů, detekce a screeningy pro bono byly aktivně prováděny na venkově v Číně.UCOM vyžadují zlepšenou dostupnost, aby se kvalifikovaly jako proveditelný screeningový nástroj, zejména pro zaostalé oblasti.
Zatímco výsledky aplikace UCOM v včasné detekci jsou slibné, o UCOM existuje mnoho neznámých.S aktivním průzkumem je zaručen další výzkum o tom, proč jsou UCOM všeobecně přítomny u rakoviny.Základní epigenetické regulační mechanismy, které jsou základem UCOM, si zaslouží další výzkum, který by mohl ospravedlnit nový směr léčby rakoviny.Vrátíme-li se k souhře mezi homogenitou a heterogenitou nádoru, zajímá nás, proč mohou být UCOM výjimkou z většiny rakovinných biomarkerů, které jsou úzce spojeny se specifickými typy rakoviny.Role metylačních aberací DNA identifikovaných UCOM v tumorigenezi, progresi tumoru a metastázách nebyla v procesu ztráty a znovuzískání buněčné identity stanovena a vyžaduje důkladnou kontrolu.Další velký zájem spočívá v rozsahu začlenění znaku homogenity UCOM s tkáňově jedinečnými markery v naději, že se přiblíží přesné detekci stop rakoviny a identifikaci původu nádorové tkáně obráceným způsobem.UCOM mohou být ideálním nástrojem pro prevenci rakoviny, detekci rakoviny a potenciální obranu a odstranění rakoviny.
Grant podporu
Tato práce byla podpořena Národním klíčovým programem pro výzkum a vývoj Číny (Grant č. 2022BEG01003), Čínskou národní přírodní vědeckou nadací (Grant č. 32270645 a 32000505), grantem provinční zdravotní komise Heilongjiang (Grant č. 2020-111) a grant od Heze Science and Technology Institute (grant č. 2021KJPT07).
Prohlášení o střetu zájmů
Wei Li je ředitel výzkumu a vývoje společnosti Shanghai Epiprobe Biotechnology Co., Ltd. Wenqiang Yu je členem vědeckého poradního výboru společnosti Epiprobe.W. Yu a Epiprobe schválili čekající patenty související s touto prací.Všichni ostatní autoři neuvádějí žádné konkurenční zájmy.
Autorské příspěvky
Navrhli a navrhli projekt: Chengchen Qian a Wenqiang Yu.
Napsal článek: Chengchen Qian.
Vytvořil ilustrace: Chengchen Qian.
Zkontrolovali a upravili rukopis: Xiaolong Zou, Wei Li, Yinshan Li a Wenqiang Yu.
Reference
1. Sung H, Ferlay J, Siegel RL, LaversanneM, Soerjomataram I, Jemal A, et al.Global Cancer Statistics 2020: odhady GLOBOCAN
výskyt a úmrtnost na celém světě u 36 druhů rakoviny ve 185 zemích.CA Cancer J Clin.2021;71: 209-49.
2. Xia C, Dong X, Li H, Cao M, Sun D, He S a kol.Statistiky rakoviny v Číně a Spojených státech, 2022: profily, trendy a determinanty.Chin MedJ (Anglie).2022;135: 584-90.
3. Siegel RL, Miller KD, WagleNS, JemalA.Statistika rakoviny, 2023. CA Cancer J Clin.2023;73: 17-48.
4. Crosby D, BhatiaS, Brindle KM, Coussens LM, Dive C, Emberton M, et al.Včasné odhalení rakoviny.Věda.2022;375: eaay9040.
5. Ladabaum U, Dominitz JA, KahiC, Schoen RE.Strategie pro
screening kolorektálního karcinomu.Gastroenterologie.2020;158: 418-32.
6. Tanoue LT, Tanner NT, Gould MK, Silvestri GA.Screening rakoviny plic.Am J Respir Crit Care Med.2015;191: 19-33.
7. Bouvard V, WentzensenN, Mackie A, Berkhof J, Brotherton J, Giorgi-Rossi P a kol.Pohled IARC na screening rakoviny děložního čípku.N EnglJ Med.2021;385: 1908-18.
8. Xue P, Ng MTA, QiaoY.Výzvy kolposkopie pro screening rakoviny děložního čípku v LMIC a řešení umělou inteligencí.BMC Med.2020;18:169.
9. Johnson P, Zhou Q, Dao DY, Lo YMD.Cirkulující biomarkery v diagnostice a léčbě hepatocelulárního karcinomu.Nat Rev Gastroenterol Hepatol.2022;19: 670-81.
10. Van PoppelH, Albreht T, Basu P, HogenhoutR, CollenS, Roobol M. Časná detekce rakoviny prostaty na základě PSA v séru v Evropě a ve světě: minulost, přítomnost a budoucnost.Nat Rev Urol.2022;19:
562-72.
11. HolyoakeA, O'Sullivan P, Pollock R, Best T, Watanabe J, KajitaY,
a kol.Vývoj multiplexního RNA testu moči pro detekci a stratifikaci karcinomu z přechodných buněk močového měchýře.Clin Cancer Res.2008;14: 742-9.
12. Feinberg AP, Vogelstein B. Hypometylace odlišuje geny některých lidských rakovin od jejich normálních protějšků.Příroda.1983;301: 89-92.
13. Ng JM, Yu J. Promotorová hypermetylace tumor supresorových genů jako potenciální biomarkery u kolorektálního karcinomu.IntJ Mol Sci.2015;16: 2472-96.
14. Esteller M. Cancer epigenomics: DNA methylomes a histon-modification maps.Nat Rev Genet.2007;8: 286-98.
15. Nishiyama A, Nakanishi M. Navigace v oblasti metylace DNA u rakoviny.Trendy Genet.2021;37: 1012-27.
16. Xie W, Schultz MD, ListerR, Hou Z, Rajagopal N, Ray P a kol.Epigenomická analýza multilineární diferenciace lidských embryonálních kmenových buněk.Buňka.2013;153: 1134-48.
17. Li Y, Zheng H, Wang Q, Zhou C, WeiL, Liu X a kol.Genomové analýzy odhalují roli Polycombu při podpoře hypomethylace methylačních údolí DNA.Genome Biol.2018;19:18.
18. Koch A, JoostenSC, Feng Z, de Ruijter TC, DrahtMX, MelotteV,
a kol.Analýza metylace DNA u rakoviny: umístění znovu navštíveno.Nat Rev Clin Oncol.2018;15: 459-66.
19. KleinEA, Richards D, Cohn A, TummalaM, Lapham R, Cosgrove D, et al.Klinická validace cíleného testu časné detekce multirakovin založeného na metylaci pomocí nezávislé validační sady.Ann Oncol.2021;32: 1167-77.
20. Hanahan D, Weinberg RA.Charakteristické znaky rakoviny.Buňka.2000;100: 57-70.
21. Hanahan D. Charakteristické znaky rakoviny: nové dimenze.Cancer Discov.2022;12: 31-46.
22. Schwartzberg L, Kim ES, Liu D, Schrag D. Precizní onkologie: kdo, jak, co, kdy a kdy ne?Kniha Am Soc Clin Oncol Educ.2017: 160-9.
23. Liu H, Meng X, Wang J. Kvantitativní methylace v reálném čase
detekce genu PAX1 ve screeningu rakoviny děložního čípku.IntJ Gynecol Cancer.2020;30: 1488-92.
24. Imperiale TF, RansohoffDF, Itzkowitz SH, Levin TR, Lavin P, Lidgard GP a kol.Multitargetstool DNA testování pro screening kolorektálního karcinomu.N EnglJ Med.2014;370: 1287-97.
25. Li J, Li Y, Li W, Luo H, Xi Y, Dong S a kol.Polohování vodítka
sekvenování identifikuje aberantní vzorce methylace DNA, které mění buněčnou identitu a sítě pro dohled nad imunitou nádorů.Genom
Res.2019;29: 270-80.
26. Gao Q, LinYP, Li BS, Wang GQ, Dong LQ, Shen BY a kol.Nerušivá detekce multi-rakovin pomocí cirkulujícího bezbuněčného methylačního sekvenování DNA (THUNDER): vývoj a nezávislé ověřovací studie.Ann Oncol.2023;34: 486-95.
27. Dong S, Li W, Wang L, Hu J, Song Y, Zhang B a kol.Geny související s histony jsou u rakoviny plic hypermetylované a hypermetylované
HIST1H4F by mohl sloužit jako biomarker rakoviny.Cancer Res.2019;79: 6101-12.
28. HeijnsdijkEA, Wever EM, AuvinenA, Hugosson J, Ciatto S, Nelen V, et al.Účinky screeningu prostatického specifického antigenu na kvalitu života.N EnglJ Med.2012;367: 595-605.
29. LuzakA, Schnell-Inderst P, Bühn S, Mayer-Zitarosa A, Siebert U. Klinická účinnost screeningových biomarkerových testů rakoviny nabízených jako samoplatební zdravotní služba: systematický přehled.Eur J Veřejné zdraví.2016;26: 498-505.
30. Dong S, Lu Q, Xu P, Chen L, Duan X, Mao Z a kol.
Hypermetylovaný PCDHGB7 jako univerzální marker pouze rakoviny a jeho aplikace v časném screeningu rakoviny děložního čípku.Clin Transl Med.2021;11: e457.
31. Yuan J, Mao Z, Lu Q, Xu P, Wang C, Xu X a kol.Hypermethylovaný PCDHGB7 jako biomarker pro včasnou detekci karcinomu endometria ve vzorcích endometriálního kartáčku a cervikálních seškrabech.Přední Mol Biosci.2022;8: 774215.
32. Dong S, Yang Z, Xu P, Zheng W, Zhang B, Fu F a kol.Vzájemně
exkluzivní epigenetická modifikace na SIX6 s hypermetylací pro sledování prekancerózního stadia a vzniku metastáz.Signal Transduct Target Ther.2022;7:208.
33. Huang L, Guo Z, Wang F, Fu L. Mutace KRAS: od neléčitelného k podléčitelnému u rakoviny.Signal Transduct Target Ther.2021;6: 386.
34. Belinsky SA, Nikula KJ, PalmisanoWA, MichelsR, SaccomannoG, GabrielsonE a kol.Aberantní metylace p16(INK4a) je ranou událostí u rakoviny plic a potenciálním biomarkerem pro časnou diagnostiku.Proč Natl Acad Sci U SA.1998;95: 11891-6.
35. Robertson KD.Metylace DNA a lidská onemocnění.Nat Rev Genet.2005;6: 597-610.
36. WentzensenN, Walker JL, Gold MA, Smith KM, ZunaRE,
Mathews C, a kol.Vícenásobné biopsie a detekce prekurzorů rakoviny děložního čípku při kolposkopii.J Clin Oncol.2015;33: 83-9.
37. De Strooper LM, Meijer CJ, Berkhof J, Hesselink AT, Snijders
PJ, Steenbergen RD, a kol.Methylační analýza FAM19A4
gen v cervikálních seškrabech je vysoce účinný při detekci cervikálních
karcinomy a pokročilé léze CIN2/3.Cancer Prev Res (Phila).2014;7: 1251-7.
38. Thajský AA, Solomon BJ, Sequist LV, Gainor JF, Heist RS.Rakovina plic.Lanceta.2021;398: 535-54.
39. Grunnet M, Sorensen JB.Karcinoembryonální antigen (CEA) jako nádorový marker u rakoviny plic.Rakovina plic.2012;76: 138-43.
40. Wood DE, KazerooniEA, Baum SL, EapenGA, EttingerDS, Hou L a kol.Screening rakoviny plic, verze 3.2018, Pokyny pro klinickou praxi NCCN v onkologii.J Natl Compr Canc Netw.2018;16: 412-41.
41. American Cancer Society.Fakta a čísla o rakovině.Atlanta, GA, USA: American Cancer Society;2023 [aktualizováno 1. března 2023;citováno 22. srpna 2023].
42. FonthamETH, Wolf AMD, Church TR, EtzioniR, Flowers CR,
Herzig A, a kol.Screening rakoviny děložního čípku u jedinců s průměrným rizikem: aktualizace pokynů pro rok 2020 od American Cancer Society.CA Cancer J Clin.2020;70: 321-46.
43. Clarke MA, Long BJ, Del Mar MorilloA, Arbyn M, Bakkum-Gamez JN, Wentzensen N. Asociace rizika rakoviny endometria s postmenopauzálním krvácením u žen: systematický přehled a metaanalýza.JAMA Intern Med.2018;178: 1210-22.
44. Jacobs I, Gentry-MaharadžA, Burnell M, ManchandaR, Singh N,
Sharma A, a kol.Citlivost transvaginálního ultrazvukového screeningu
pro karcinom endometria u žen po menopauze: studie případ-kontrola v rámci kohorty UKCTOCS.Lancet Oncol.2011;12: 38-48.
45. BabjukM, Burger M, CompératEM, Gontero P, MostafidAH,
PalouJ a kol.Směrnice Evropské urologické asociace pro neinvazivní rakovinu močového měchýře (TaT1 a karcinom in situ) -
Aktualizace 2019.Eur Urol.2019;76: 639-57.
46. Aragon-Ching JB.Výzvy a pokroky v diagnostice, biologii a léčbě uroteliálních karcinomů horního traktu a močového měchýře.Urol Oncol.2017;35: 462-4.
47. Rizvi S, KhanSA, Hallemeier CL, Kelley RK, Gores GJ.
Cholangiokarcinom – vyvíjející se koncepty a terapeutické strategie.Nat Rev Clin Oncol.2018;15: 95-111.
48. Ye Q, Ling S, Zheng S, Xu X. Tekutá biopsie v hepatocelulárním
karcinom: cirkulující nádorové buňky a cirkulující nádorová DNA.Mol Cancer.2019;18:114.
49. Zhang Y, Yao Y, Xu Y, Li L, Gong Y, Zhang K a kol.Pan-rakovina
detekce cirkulující nádorové DNA u více než 10 000 čínských pacientů.Nat Commun.2021;12:11.
50. Eisenhauer EA, Therasse P, BogaertsJ, Schwartz LH, Sargent D, Ford R a kol.Nová kritéria hodnocení odpovědi u solidních nádorů: revidovaný pokyn RECIST (verze 1.1).Eur J Cancer.2009;45: 228-47.
51. LitièreS, Collette S, de Vries EG, Seymour L, BogaertsJ.RECIST – učení se z minulosti k budování budoucnosti.Nat Rev Clin Oncol.
2017;14: 187-92.
52. Seymour L, BogaertsJ, Perrone A, FordR, Schwartz LH, Mandrekar S, et al.iRECIST: pokyny pro kritéria odezvy pro použití ve studiích
testování imunoterapeutik.Lancet Oncol.2017;18: e143-52.
53. PantelK, Alix-Panabières C. Tekutá biopsie a minimální reziduální nemoc – nejnovější pokroky a důsledky pro léčbu.Nat Rev Clin Oncol.2019;16: 409-24.
Citujte tento článek jako: Qian C, Zou X, Li W, Li Y, Yu W. Základna proti rakovině: univerzální markery pouze pro rakovinu.Cancer Biol Med.2023;20: 806-815.
doi: 10.20892/j.issn.2095-3941.2023.0313
Čas odeslání: květen-07-2024